Lezione 31 - Chimica applicata
I detergenti e i disinfettanti
I termini detergente e disinfettante sono spesso confusi tra loro, mentre identificano una funzione ben precisa.
I detergenti hanno lo scopo di asportare le impurità da superfici di vario genere (detergere).
Invece i disinfettanti comprendono un vasto gruppo di sostanze formulate per ridurre drasticamente la presenza di batteri, virus, spore e, in alcuni casi, alghe o altri microorganismi. Per tali caratteristiche sono usati per la disinfezione di ambienti, superfici e oggetti di varia natura, nel settore medico-chirurgico, nell’industria, nella produzione alimentare e nell’allevamento.
Esiste inoltre un altro tipo di prodotti che servono per eliminare insetti, roditori, acari ecc., definiti disinfestanti.
I disinfettanti e i disinfestanti rientrano nella categoria dei biocidi.
Dato che contengono sostanze nocive per l’uomo e per gli ecosistemi, i biocidi sono soggetti a una procedura di autorizzazione per essere messi in commercio, al fine di garantire un elevato livello di tutela della salute umana, animale e dell’ambiente.
Accade di frequente che la pubblicità di molti detergenti di uso domestico evidenzi le proprietà antibatteriche e disinfettanti, ma in realtà il regolamento UE sui prodotti biocidi (n. 528/2012) esclude dalla definizione dei disinfettanti tutti i detergenti (detersivi liquidi e in polvere) privi di una reale attività disinfettante. (Fonte: www.issalute.it.)
I detergenti
I detergenti sono sostanze o miscele contenenti saponi e/o altri tensioattivi.
I saponi sono sali sodici o potassici di acidi grassi a lunga catena alifatica (vedi le Lezioni 27 e 29 di Chimica).
I saponi sono in genere solubili in acqua, dove si dissociano in ioni sodio o potassio e ioni carbossilato, costituiti da una lunga «coda» idrocarburica alla cui estremità si trova la «testa» —COO–.
Pertanto, gli ioni carbossilato degli acidi grassi sono molecole anfipatiche: presentano una coda apolare con comportamento idrofobo e una testa ionica idrofila.
Quando un sapone si dissocia in acqua, gli ioni carbossilato non si disperdono uno a uno in soluzione ma si riuniscono in aggregati sferici, chiamati micelle. Le teste idrofile —COO– si rivolgono verso lo strato acquoso mentre le code idrofobe si dirigono verso l’interno della micella e sono in grado di interagire con le molecole di grasso, anch’esse apolari, disperdendole in acqua
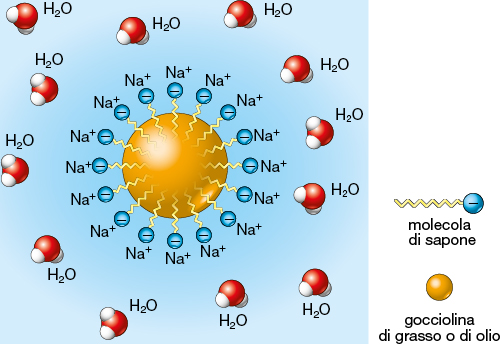
Per poter esercitare con efficacia la sua azione detergente, il sapone ha bisogno di un’acqua non troppo dura, cioè con un basso contenuto di sali di calcio e magnesio. In caso contrario, si formano sali insolubili che allontanano il sapone dall’ambiente acquoso:
| 2 C17H35COO–(aq) | + | Ca2+(aq) | → | (C17H35 COO–)2Ca2+(s) |
| ioni stearato | stearato di calcio (insolubile) |
Per ovviare a questo inconveniente, sono stati approntati dall’industria detergenti sintetici la cui struttura complessiva è molto simile a quella dei saponi. Essi, infatti, possiedono lunghe catene apolari alla cui estremità sono legati gruppi polari o ionici.
A seconda della natura di tali gruppi, i detergenti vengono classificati come anionici, cationici e non ionici.
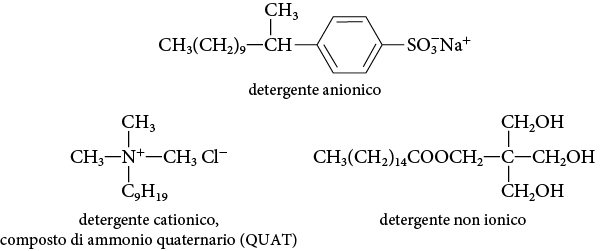
I saponi e i detergenti sintetici, per la loro struttura, riducono la tensione superficiale dell’acqua, perché possa meglio bagnare gli oggetti, penetrando lungo le superfici. In generale, gli agenti chimici con questo comportamento sono detti tensioattivi.
I tensioattivi, quindi, sono sostanze che hanno la proprietà di modificare la tensione superficiale di un sistema bifasico (per esempio acqua e olio) o polifasico.
I composti di ammonio quaternario (QUAT) hanno un’azione antibatterica, per cui rientrano nella categoria dei disinfettanti.
I disinfettanti
I principali tipi di disinfettanti sono i seguenti.
- Alcol etilico e alcool propilico (CH3–CH2–OH e CH3–CH2–CH2–OH): si usano per disinfettare superfici e strumenti (a eccezione di quelli da sala operatoria), o la pelle priva di ferite, cioè intatta, per esempio prima di effettuare un’iniezione.
- Ipoclorito di sodio (NaClO): ha un’azione disinfettante efficiente contro batteri, virus, muffe e spore anche a basse concentrazioni. È comunemente conosciuto anche con il nome di candeggina o varechina (3-5%), euclorina o amuchina (1,5%). A concentrazioni comprese tra 5 e 10%, può essere irritante per pelle e occhi (così come indicato sull’etichetta), mentre a concentrazioni superiori al 10% deve essere considerato un agente corrosivo: è necessario, quindi, usarlo con particolare cura. L’ipoclorito di sodio in presenza di acidi sviluppa cloro, che è un gas tossico; a contatto con ammoniaca genera clorammina, che è irritante; a contatto con acqua ossigenata sviluppa ossigeno, che non è tossico, però annulla la sua azione disinfettante. Per questi motivi, l’ipoclorito di sodio non deve essere mescolato con altri prodotti per evitare effetti indesiderati sulla salute degli operatori.
- Acqua ossigenata, o perossido di idrogeno (H2O2): agisce con un meccanismo simile a quello dell’ipoclorito su batteri, spore, virus e lieviti, ma è meno efficiente. È ampiamente disponibile sul mercato diluita a diverse concentrazioni (dal 3 al 12%). Nella sua forma diluita è usata soprattutto per disinfettare piccole ferite, in ambito domestico.
- Composti di ammonio quaternario (QUAT): privi di un colore o di un odore specifico, sono molto usati per la disinfezione di superfici e ambienti (per esempio nelle mense e negli impianti dell’industria alimentare). Eliminano i batteri e la maggior parte dei virus, ma generalmente non le spore.
- Ossido di etilene (C2H4O): per la sua elevata efficacia nei confronti di batteri, funghi, virus e spore, è usato soprattutto per sterilizzare strumenti chirurgici, sale operatorie e contenitori per farmaci e/o alimenti: la distruzione dei microorganismi è totale. A temperatura ambiente è un gas e, poiché è infiammabile e tossico, può essere maneggiato solo da personale esperto.
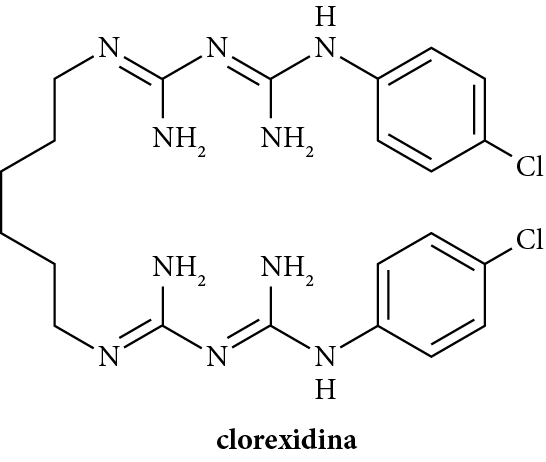
- Disinfettanti contenenti iodio o clorexidina: usati per disinfettare ferite aperte in alternativa a prodotti come l’acqua ossigenata.
La disinfezione, oltre che con i prodotti biocidi ad azione disinfettante, può esser eseguita con radiazioni ultraviolette o con mezzi fisici come il calore (aria calda, vapore o acqua bollente).
(Fonte: www.issalute.it)
Copyright © 2023 Zanichelli editore S.p.A.
