|
Separazione
di proteine
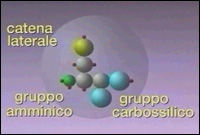
Le proteine
hanno una carica totale positiva o negativa che dipende dalla
loro sequenza di aminoacidi. Gli aminoacidi,
infatti, hanno una catena laterale che può essere di 20
tipi, alcuni dei quali hanno atomi con cariche positive o negative.
 Alla
metà degli anni 1960 è stata sviluppata una versione
perfezionata di elettroforesi, comunemente nota come SDS-PAGE
(PolyAcrilamide-Gel Electrophoresis), basata sull'utilizzo di
un supporto inerte costituito da molecole di poliacrilamide e
che può essere utilizzato per separare qualunque tipo di
proteina. Alla
metà degli anni 1960 è stata sviluppata una versione
perfezionata di elettroforesi, comunemente nota come SDS-PAGE
(PolyAcrilamide-Gel Electrophoresis), basata sull'utilizzo di
un supporto inerte costituito da molecole di poliacrilamide e
che può essere utilizzato per separare qualunque tipo di
proteina.
La
poliacrilamide è una molecola con la capacità di
formare catene che in acqua si trovano in sospensione sotto forma
di gel.
 Sciogliamo
una quantità di monomero (acrilamide) tale da ottenere
un polimero (poliacrilamide) alla concentrazione desiderata (tra
il 7% e il 15%). Sciogliamo
una quantità di monomero (acrilamide) tale da ottenere
un polimero (poliacrilamide) alla concentrazione desiderata (tra
il 7% e il 15%).
Il
gel contiene un detergente carico negativamente, il Sodio Dodecil
Solfato (SDS) che, legandosi alle regioni idrofobe
delle molecole proteiche, ne causa la denaturazione.
Questo detergente
è carico negativamente e impedisce agli aminoacidi di stabilire
i legami deboli che creano la struttura tridimensionale della
proteina.
Grazie alla
presenza di SDS le proteine migrano dal polo negativo al polo
positivo con velocità indipendente dalla loro carica totale
e dalla loro forma, ma solo sulla base del peso molecolare.
Esse infatti hanno la stessa forma, poiché denaturate,
e hanno tutte cariche negative.
Come
si prepara un gel di poliacrilamide?
Separazione
di frammenti di DNA
|