|
Come
si prepara un gel di poliacrilamide?
 Il
gel viene fatto polimerizzare
fra due vetri separati da due strisce di plastica molto sottili
(da 0,5 a 1,5 mm). Su un lato viene inserito un "pettine"
che serve da stampo per la creazione dei pozzetti, piccoli
buchi dove verrà deposta la soluzione contenente le proteine. Il
gel viene fatto polimerizzare
fra due vetri separati da due strisce di plastica molto sottili
(da 0,5 a 1,5 mm). Su un lato viene inserito un "pettine"
che serve da stampo per la creazione dei pozzetti, piccoli
buchi dove verrà deposta la soluzione contenente le proteine.
Una
volta polimerizzato, il gel è deposto in un'apposita vasca
e coperto di tampone di corsa, una soluzione che mantiene
il pH
costante, anch'essa contenente SDS.
A
questo punto si è pronti per caricare i campioni contenenti
le proteine, che sono disciolte in una soluzione di saccarosio,
SDS e β-mercaptoetanolo (con la funzione di rompere eventuali
ponti
disolfuro).
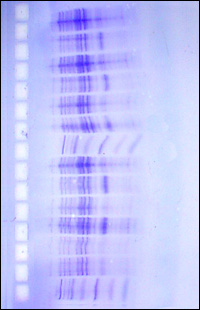 Dopo
la corsa elettroforetica le proteine non sono visibili sul gel,
a meno che non vengano visualizzate tramite colorazione con il
Blu Coomassie, un colorante organico che si lega molto specificamente
alle proteine. Dopo
la corsa elettroforetica le proteine non sono visibili sul gel,
a meno che non vengano visualizzate tramite colorazione con il
Blu Coomassie, un colorante organico che si lega molto specificamente
alle proteine.
Si
spegne la corrente e si toglie il gel dai vetri. Con delicatezza
si immerge il gel in una soluzione di Blu Coomassie 0,1% disciolto
in acqua-metanolo-acido acetico e lo si lascia per alcune ore.
Tutto il gel diventerà blu e le bande saranno difficili
da scorgere; allora bisogna decolorare il gel in isopropanolo-acido
acetico e le bande proteiche, alle quali il colorante è
legato saldamente, questa volta saranno nettamente visibili.
È
possibile, sempre tramite l'applicazione di un campo elettrico,
trasferire le proteine su una membrana di nitrocellulosa e visualizzarle
tramite anticorpi
specifici.
Elettroforesi
bidimensionale
Separazione
di frammenti di DNA
|